Batteridriftsprinsipp
Hvordan fungerer en veggklokke, en fjernkontroll til fjernsynet eller et radiostyrt barneleke? De fleste vil uten å nøle svare "fra batterier", og i prinsippet vil de ha rett. Men det er usannsynlig at noen av dem vil være i stand til å fortelle nøyaktig hvordan det bærbare batteriet tredobles, hvordan det fungerer, og uten hvilken hele prosessen med å overføre elektrisk strøm fra batteriet til sluttforbrukeren ville være umulig. La oss fylle dette irriterende gapet i kunnskap.
Innholdet i artikkelen
Batteridriftsprinsipp
For å forstå driftsprinsippet til et konvensjonelt AA-batteri, må du ha en generell forståelse av strukturen. Så ethvert batteri består av tre hovedelementer - anode, katode og elektrolytt. Dessuten kan sistnevnte ha praktisk talt hvilken som helst tilstand av aggregering: katoden og anoden plassert i en saltvannsløsning er i prinsippet også et "batteri", bare i en form som er uvanlig for den gjennomsnittlige personen.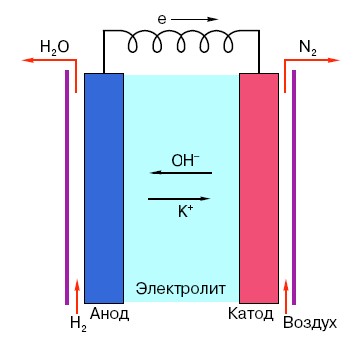
Interessant! Den såkalte "voltaiske kolonnen", oppfunnet av Alessandro Volta, hadde også alle elementene som er nødvendige for produksjon av elektrisk strøm. Den besto av sink- og kobberplater stablet oppå hverandre, mellom hvilke en klut dynket i syre ble lagt som et "lag".
Anoden i slike systemer er hovedkilden til elektroner, som, som vi vet fra et skolefysikkkurs, har en negativ ladning.Negativt ladede partikler tiltrekkes av positive, og i dette tilfellet fungerer katodeoverflaten som et "pluss".
Men dette er ikke nok for at en elektrisk strøm skal oppstå, fordi elektroner også trenger en slags "motorvei" - et medium som vil støtte interaksjonen mellom katoden og anoden. Det er her en elektrolytt vises "på scenen" - et salt, alkali eller syre som er i stand til å lede strøm.
La oss se på operasjonsprinsippet ved å bruke et spesifikt eksempel: det er et batteri vurdert til 18 volt. Spenningen mellom elektrodene i den er stabil til den kobles til nettverket. Så snart en forbruker dukker opp (for eksempel en vanlig lyspære), begynner spenningen gradvis å synke, strømmen begynner å flyte fra den "negative" elektroden til den "positive", og det oppstår en kjemisk reaksjon i elektrolytten rettet mot opprettholde potensialforskjellen mellom elektrodene.
Henvisning. Jo mer energi forbrukeren trenger, desto mer intens blir reaksjonen inne i batteriet, og jo raskere vil den svikte.
Hvordan et oppladbart batteri fungerer, hvordan det skiller seg fra et vanlig
Så vi har sett på de klassiske "finger"- og "lillefinger"-batteriene, og vi vet at levetiden til de fleste av dem er strengt begrenset (uansett hva kjente produsenter sier). Men hva med de såkalte batteriene - batterier av batteritype som ikke bare kan forbruke energi under reaksjonsprosessen, men også akkumulere den og lagre den i lang tid?
For å forstå prinsippet for drift av batteriet, er det nødvendig å vende seg til kjemi. La oss ta som et eksempel... En vanlig kullbål.Uansett hvor vakker og fascinerende flammen ser ut, vet enhver kjemiker som observerer den at denne prosessen bare er en langsiktig reaksjon av drivstoffoksidasjon. Brenning av kull interagerer med oksygen og som et resultat av denne reaksjonen får vi:
- karbondioksid;
- lys;
- varm.
Og hvis de to siste punktene er i stand til å varme opp sjelen og kroppen, så kan vi ikke bruke karbondioksid på noen måte, fordi det er et biprodukt av reaksjonen, som faktisk er dens avfall. Oksydasjonsreaksjonen stopper når startelementene: oksygen og kull går tom. Å stoppe reaksjonen i et batteri skjer på nøyaktig samme måte når startstoffene er helt oppbrukt og bare "avfall" gjenstår.
I batteriet skjer alt litt annerledes. Faktum er at reaksjonen som oppstår i den tilhører kategorien reversibel, det vil si at den under visse forhold kan "reverseres", og returnerer alle stoffer til sin opprinnelige tilstand. Det er muligheten for at en reversibel reaksjon oppstår i batteriet som gjør at det kan lades.
I et batteri koblet til nettverket fortsetter reaksjonen i motsatt retning, og strømmen flyter fra "pluss" til "minus", og ikke omvendt. Som et resultat danner reaksjonsproduktet startstoffene, og eieren av batteriet mottar tilgjengelig "gjenvunnet" energi i et bærbart format. Det er alt!





